人多能干细胞(hPSC),包括人胚胎干细胞(hESC)与诱导多能干细胞细胞( hiPSCs ),可诱导成为功能性运动神经元(MNs),从而提供可靠的、直接的方法接近人的MNs,用于MN相关疾病的基础研究和基于细胞的治疗,目前hPSC MN的分化方案完全依赖于生化因素,,因为体外培养条件不清晰的,分化工艺持久,分化收率和纯度低,所以分化效果未达到最佳。最近被证实,干细胞微环境中共存的生物物理信号,包括纳米形貌,可以为成体干细胞行为提供强有力的调节信号,包括自我更新和分化。
密歇根大学陈伟强和付建平研究了纳米结构调控人多能干细胞运动神经元的分化,成果发表于2018年1月发表在Nanoscale上。
利用最近发展起来的基于反应离子蚀刻(RIE)的大规模纳米制造技术,以高精度和再现性在玻璃表面上产生随机纳米结构。hPSCs对纳米结构敏感,这种纳米结构敏感性可用于改善hPSCs的定向神经元分化。使用纳米工程结构的基底可以促进早期神经上皮转化和hPSCs运动神经元(MN)原细胞分化。探讨了hPSCs如何感知基底的纳米形貌,如何通过调节信号网络(包含细胞粘附、肌动球蛋白细胞骨架和Hippo/YAP)传递这种生物物理信号调节hPSCs的神经上皮诱导。本研究为从hPSCs中大规模生产MNs提供了一种有效的方法,可用于再生医学和细胞治疗。
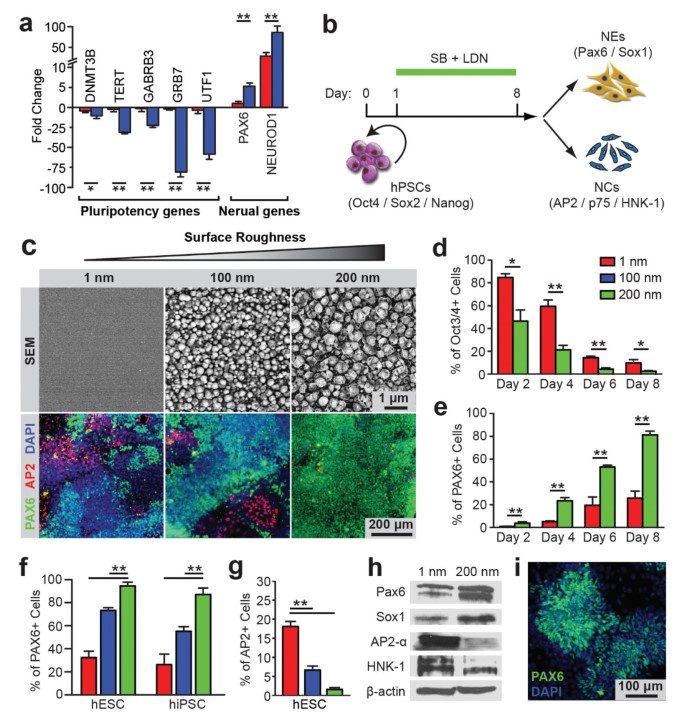

图1显示在生长介质条件下,未处理的光滑玻璃表面有利hPSC的自我更新和多能维持,而纳米玻璃促进hPSC的自发分化成神经元,纳米形貌基质可促进hPSC神经上皮转化。单独分离的hPSC接种于玻连蛋白涂覆的表面纳米粗糙度不同的玻璃上,每平方厘米20000个细胞,在含有双Smad抑制剂、SB 410842和LDN 193189的神经诱导培养基中培养8天(图1b ),神经诱导通过早期神经外胚层分化标志物Pax 6检测。第2天在Rq =200 nm的粗糙衬底上检测到PAX6 +神经上皮细胞(NECs),到第8天hiPSCs达到88.6 %,hESCs达到95.5 %。与此形成鲜明对比的是,在光滑玻璃(Rq=1 nm)上,第4天出现PAX6 + NECs,第8天仅占细胞总数的32.2 %。


图2检查了源自纳米粗糙玻璃的NECs是否可指定为脊柱MN元细胞,使用少突胶质细胞转录因子2作为早期的MN标记。当源于hPSC的NECs在腹式化因子2,6,9-三元取代嘌呤( Pur )和尾式化因子维甲酸(RA)存在下连续培养8天时,在纳米粗糙表面上(Rq=200 nm),58.5 %的细胞为Olig2+ MN元细胞,在光滑表面上仅11.2 %的细胞为Olig2+。
该研究揭示了纳米拓扑敏感细胞机制是如何控制hPSC的分化方向的,最近的研究表明功能性MNs可来自hESCs和hiPSCs,并在功能上整合到动物模型中。因此,来源于hPSC的MNs为神经退行性疾病模型的建立和治疗的发展提供了可靠的细胞来源。利用纳米形貌表面来改善功能性MN从干细胞的产生,对未来许多与MN相关的衰弱性疾病和病理情况如脊髓损伤、肌萎缩侧索硬化和脊肌萎缩等细胞治疗有重要意义。
文章信息:Weiqiang Chen,* Shuo Han, Weiyi Qian, Shinuo Weng, Haiou Yang, Yubing Sun, Luis G. Villa-Diaz, Paul H. Krebsbache and Jianping Fu *, Nanotopography regulates motor neuron differentiation of human pluripotent stem cells, Nanoscale, 2018, 10, 3556
