DOI: 10.1126/sciadv.aax5083
致密基质阻碍了间质细胞迁移和随后的修复。假设核刚度是迁移的一个限制因素,且认为可以通过暂时降低核刚度加快修复速度。为了测试这一点,研究者通过应用组蛋白脱乙酰基酶抑制剂曲古他汀A(TSA)或敲除丝状核蛋白Lamin A/C,研究了成年半月板细胞在核软化前后通过致密纤维网络和成年组织的间质迁移能力。结果表明,核的瞬时软化可改善通过微孔膜、电纺纤维基质和组织切片的迁移,并且处理后核特性和细胞功能得以恢复。研究者还表明,TSA的生物材料递送促进了内源性细胞对支架的体内细胞化作用。通过解决由核僵硬引起的修复的固有局限性,这项工作开发了一种促进受损致密结缔组织修复的新策略。
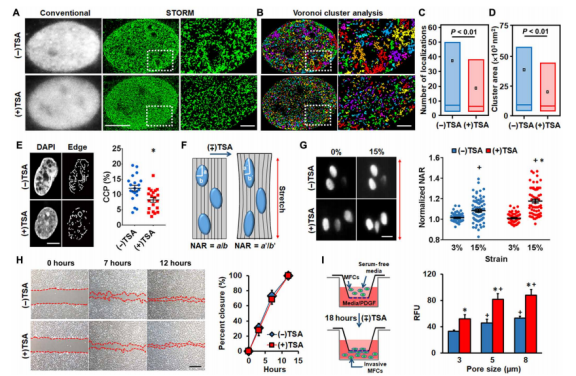
图1.TSA处理可增加半月板细胞核的可变形性和通过微孔膜的迁移。(A)对照组中组蛋白-H2B[顶部;(-)TSA]或经TSA处理的MFC核[底部;(+)TSA]的代表性常规荧光和STORM成像。(B)对应的基于Voronoi的图像分割,可对组蛋白-H2B纳米域进行可视化和量化。(C和D)用TSA处理每个簇和簇区的H2B定位数的量化。框、线和点分别对应于十分位数范围(第10至90百分位数)、中位数和平均值,Mann-Whitney U检验,n≥来自5个细胞的10584个簇。在每个Voronoi图像旁边,显示了正方形内部区域的更高放大倍率图像。(E)TSA处理3小时可减少4',6-二氨基-2-苯基吲哚(DAPI)染色核中的染色质凝聚(比例尺,5μm),并减少可见边缘的数量(左)。用TSA处理染色质凝聚参数(CCP)的定量[右;*P<0.05,相对于(-)TSA,n≈20]。(F)示意图显示了用于评估细胞变形时核变形能力和核长宽比(NAR=b/a)变化的实验设计。(G)在15%拉伸(左;比例尺,20μm)前后支架上具有代表性的DAPI染色核,以及3%和15%拉伸的NAR(n=32至58个细胞,相对于(-)TSA,*P<0.05;相对于3%,+P<0.05)。(H)2D伤口闭合试验显示,在存在或不存在TSA的情况下,间隙填充无差异。左:比例尺,200μm;右:P>0.05,n=6)。(I)带有和不带有TSA预处理的Boyden室趋化性测定的示意图(左)和通过3、5和8μm直径孔迁移的细胞信号强度[右;n=每组5个样本,相对于(-)TSA,*P<0.05;相对于3μm,+P<0.05,平均值±SD]。
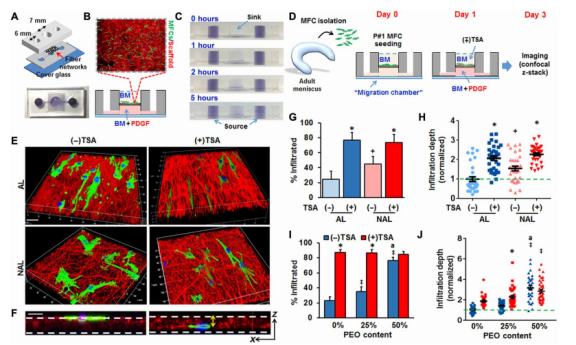
图2.核软化增强了半月板细胞通过致密纤维网络的迁移。(A)“PDMS[聚二甲基硅氧烷]/纳米纤维迁移室”的示意图(顶部)和俯视图(底部)。(B)示意图显示半月板细胞(绿色)播种到荧光标记的纳米纤维上,该纤维嵌入在含有BM的顶部储库和含有BM且添加PDGF(100 ng/ml)作为化学引诱剂的底部储库之间。(C)微型设备中可溶性因子梯度的可视化呈现,台盼蓝在上腔室中的缓慢积累随时间的变化。(D)显示半月板细胞(MFC)的分离并接种到纳米纤维基底上的实验示意图(从成年牛半月板分离)。接种后第一天,将TSA或PDGF分别添加到顶部储层或底部储层中,并将细胞再培养2天。在第3天,通过共聚焦显微镜对支架成像,以测定进入支架的细胞渗透度。(E)在有或没有TSA处理的情况下,通过AL或非AL(NAL)纳米纤维网络(AL或NAL;红色)的细胞(绿色)迁移的3D共聚焦重建。比例尺,30μm。(F)纳米纤维基质(红色)中的细胞(绿色)的横截面图。比例尺,30μm。量化浸润细胞的百分比(G)[n=5至8张图像,相对于(-)TSA,*P<0.05;相对于AL,+P<0.05,平均值±SD]和细胞浸润深度(H)[n=33个细胞,相对于(-)TSA,*P<0.05;相对于AL,+P<0.05,平均值±SEM,标准化为(-)TSA/AL组]。浸润细胞百分比的定量分析(I)[n=5张图像,相对于(-)TSA,*P<0.05;相对于0%聚环氧乙烷(PEO),‡P<0.05;相对于25%PEO,aP<0.05,平均值±SD]和细胞浸润深度(J)[n=33个细胞,相对于(-)TSA,*P<0.05;相对于0%PEO,‡P<0.05;相对于25%PEO,aP<0.05,平均值±SD,标准化为对照PCL/0%PEO组]与PEO含量的函数关系。所有实验均重复三次。
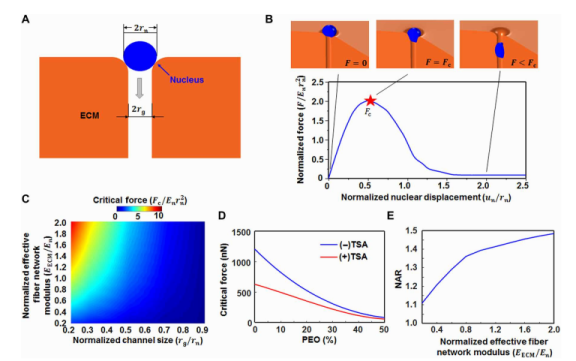
图3.通过致密纤维网络进行细胞迁移的计算模型。(A)示意图显示了一个狭窄通道上方的核(蓝色),代表了致密纤维网络(橙色)中的小孔。几何参数是核的半径(rn)和通道的半宽度(rg)。刚度参数是核的模量(En)和纤维网络(EECM)。为简单起见,将核视为球体。(B)核进入并通过致密纤维网络通道的模拟。核遇到的归一化阻力与核归一化位移的函数关系。最大归一化阻力定义为临界力。(C)临界力与归一化ECM模量(相对于En)和归一化通道尺寸(相对于rn)的函数关系。当ECM变硬或通道变小时,临界力会更大。(D)临界力随着PEO含量的增加而降低。TSA处理还降低了临界力,特别是对于致密网络(PEO含量低)。(E)进入通道后的归一化NAR随着ECM变硬或核变软而增加(两者都会导致更大的归一化ECM模量EECM/En)。
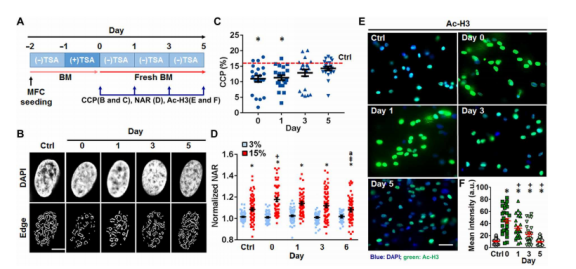
图4.停止TSA后染色质凝聚、核变形能力和组蛋白乙酰化水平的变化。(A)显示实验装置的示意图;在有/无TSA处理的情况下,将成年MFC接种在BM中的AL纳米纤维支架上1天,然后在没有TSA的新鲜BM中再培养5天。(B)代表性DAPI染色细胞核(上)和相应的可见边缘检测(下)(比例尺,3μm)和(C)(A)中所示时间点的染色质凝聚参数(红线;第0天的BM对照),n≈20个核,相对于对照组,*P<0.05,平均值±SEM。(D)施加拉伸强度为3%和15%的NAR(归一化为0%的NAR,n=65〜80个细胞,相对于3%,*P<0.05;相对于对照组,+P<0.05;相对于第0天,‡P<0.05;相对于第1天,aP<0.05,平均值±SEM)。(E)细胞核(蓝色)中Ac-H3K9(绿色)的免疫染色和免疫染色平均强度的定量分析(F)(n≈28个细胞,相对于对照组,*P<0.05;相对于day 0,+P<0.05,平均值±SEM]。a.u.,任意单位,所有实验均一式三份进行。
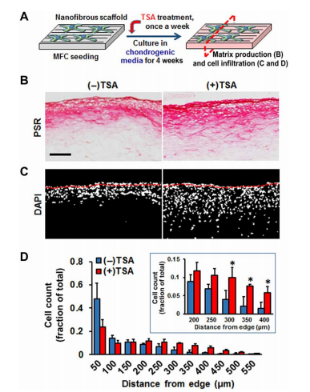
图5.核软化促进工程化构建体中的细胞入侵。(A)实验示意图显示MFC播种在PCL/25%PEO纳米纤维支架上,该支架在化学限定培养基中培养,每周进行一次TSA处理。4周后,评估了有/无TSA处理的ECM生成和细胞浸润。在第4周,对胶原蛋白(B)和细胞核(C)染色的MFC负载纳米纤维构建体的代表性横截面图像。比例尺,100μm。(D)量化有/无TSA处理的MFC渗透(n=来自3个独立样品的3张图像,相对于(-)TSA,*P<0.05,平均值±SEM)。实验一式两份进行。PSR,天狼星红。
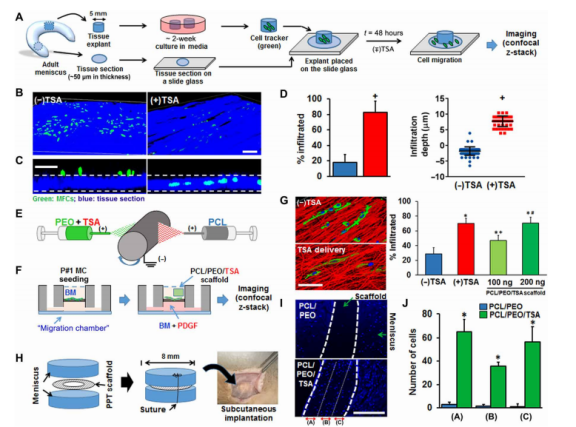
图6.核软化增强了原发组织间质性MFC的迁移。(A)示意图显示了用于入侵检测的重要组织外植体和失活组织切片的处理过程。通过共聚焦显微镜评估细胞从重要组织迁移并浸润到失活的组织切片。(B)在有/没有TSA处理的情况下,穿过失活组织切片(蓝色)的细胞(绿色)迁移3D重建(比例尺,200μm)和(C)横截面图(比例尺,50μm)。(D)量化浸润细胞的百分比[n=6张图像,相对于(-)TSA,*P<0.05,平均值±SD]和细胞浸润深度[n≈40个细胞,相对于(-)TSA,*P<0.05,平均值±SEM]。实验一式三份进行。(E)静电纺丝原理图,显示了两个独立的纤维束同时收集到一个共同的旋转心轴上。离散的纤维群由含TSA和PCL的PEO组成。(F)显示半月板细胞接种到纳米纤维基底上的实验示意图。接种后一天,将复合PCL/PEO TSA释放(PPT)支架添加到微流体腔室中,并将细胞再培养2天,然后进行共聚焦成像。(G)在有/无支架介导TSA递送的情况下,通过AL纳米纤维网络进行细胞(绿色)迁移的3D共聚焦重建(比例尺,100μm)并量化浸润细胞的百分比[n=5张图像,与(-)TSA相比,*P<0.05;与(+)TSA相比,+P<0.05;以及与100 ng相比,#P<0.05,平均值±SD。生物分子的负载量(每个支架的质量)基于静电纺丝参数和支架质量]。(H)在大鼠模型中修复构建体组件和皮下评估的示意图。(I)在有/无TSA递送的情况下,皮下植入1周后修复构建体中心的DAPI染色核(蓝色)图像。虚线表示组织-支架界面。比例尺,300μm。(J)在有/无生物材料介导TSA释放的情况下,支架每个区域内的细胞数量(n=来自三只不同动物的3个样品,与PCL/PEO相比,*P<0.05)。
