DOI:10.1016/j.eurpolymj.2020.110051
制备和优化能够通过电信号诱导适当细胞间连接的导电支架对于神经组织工程至关重要。在这项研究中,以不同的成分制备了PVA(聚乙烯醇)/PEDOT(聚(3,4-乙撑二氧噻吩))支架。测定了静电纺丝溶液和电纺支架的电导率。分析了支架的形态、拓扑结构、力学性能和水接触角。使用FTIR分析研究了支架的化学性质,通过MTT分析和细胞附着测试检测了支架的生物相容性和细胞相互作用。研究结果表明,与纯PVA支架相比,含PEDOT的支架在理化特性和细胞活性方面均得到了改善。优化支架后,使用实时PCR分析研究了大鼠间充质干细胞(MSCs)的神经分化情况。与TCP样品相比,有无电刺激诱导的支架样品显示出上调的β-微管蛋白、巢蛋白和烯醇化酶。另外,在电刺激下的支架样品中巢蛋白基因的表达比支架样品高出1.5倍。总体而言,本研究表明,利用电刺激的PVA/PEDOT导电支架可以通过模拟天然神经组织的特性来改善细胞反应和神经分化。
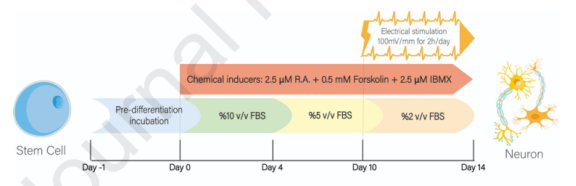
图1.用于将MSCs分化为神经元样细胞的应用分化方案的信息图示。

图2.不同支架的扫描电子显微镜图像A:纯PVA,B:PVA/PEDOT(0.1),C:PVA/PEDOT(0.3),D:PVA/PEDOT(0.6),E:PVA/PEDOT(1),以及F:PVA/PEDOT(3)。大和小图像中的比例尺分别为10µm和1µm。如前所述,增加样品中PEDOT:PSS的量会降低纤维的平均直径。
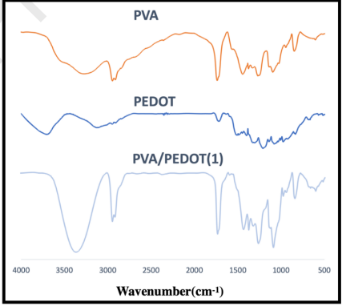
图3.PVA、PEDOT和PVA/PEDOT(1)支架样品的FTIR光谱。3125、1680和1510 cm-1附近的峰分别与芳族PSS环中O-H的伸展,噻吩环中C=C的伸展和芳族PSS环中C=C的伸展有关,这表示结构中存在PEDOT:PSS。

图4.不同表面形貌的激光扫描显微图像:A:纯PVA,B:PVA/PEDOT(0.1),C:PVA/PEDOT(0.3),D:PVA/PEDOT(0.6),E:PVA/PEDOT(1)和F:PVA/PEDOT(3)。在所有支架中,PVA/PEDOT(1)支架的Ra、Sa和Vvv最大。
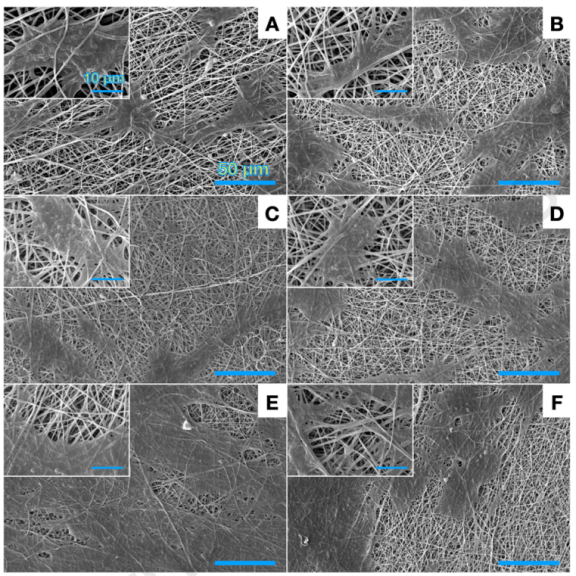
图5.培养7天后细胞扩散的SEM图像:A:纯PVA,B:PVA/PEDOT(0.1),C:PVA/PEDOT(0.3),D:PVA/PEDOT(0.6),E:PVA/PEDOT(1),以及F:PVA/PEDOT(3)。细胞在含有PEDOT的支架上显示出更好的生长。与其他细胞相比,PVA/PEDOT(1)支架显示出最佳的细胞面积。大和小图像中的比例尺分别为50µm和10µm。
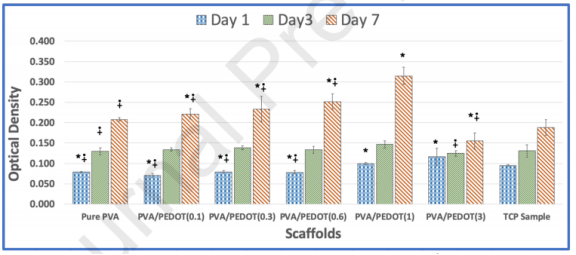
图6.通过MTT法分析MSCs在不同纳米纤维支架和TCP上的生存能力。*和∔符号表示与TCP和PVA/PEDOT(1)样品相比的显著性(p值<0.0.5)。支架样品显示出对细胞粘附和生长的更好支持。PVA/PEDOT(1)支架在培养7天后显示出对细胞活力的最佳支持,而没有任何细胞毒性迹象。应注意的是,并非所有重要样品都已标记。
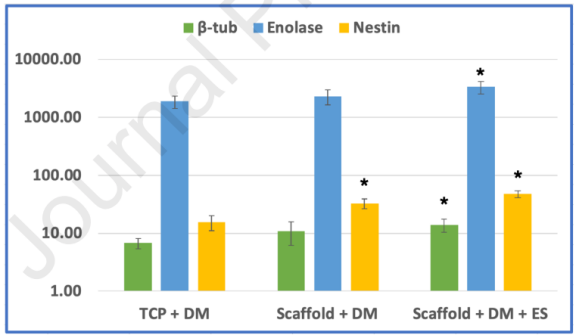
图7.在不同分化处理中神经标志物基因的表达。已经分析了在TCP样品(TCP+DM)、支架(Scaffold+DM)以及导电支架和电刺激的结合体(Scaffold+DM+ES)上培养的细胞的神经标志物β-微管蛋白、烯醇化酶和巢蛋白的表达(表2列出了有关组和相关处理的详细信息)。与未处理的TCP样品(对照)相比,对基因表达结果进行标准化。导电支架和电刺激的结合导致神经分化基因包括巢蛋白和β-微管蛋白的表达增加。*表示与TCP+DM值相比,样品具有显著性(p值<0.05)。
