DOI:10.1016/j.msec.2020.111747
为了实现对活微生物细胞的包封和固定化后细胞活性的评估,采用简便有效的静电纺丝技术将酵母细胞包埋在水溶性PAAm纳米纤维中。首先,研究了PAAm/酵母静电纺丝溶液的电导率、剪切粘度和表面张力与酵母/PAAm质量比的关系,以确定静电纺丝固定化的最佳溶液条件。静电纺丝后,酵母细胞的原始椭球形结构变成了扁球形结构。为了区分固定化结构和一般静电纺丝过程中出现的微珠,通过FESEM和EDX对固定化结构和微珠结构进行了比较和分析。采用CTC和亚甲基蓝染色法分别评估了游离细胞活性、静电纺丝后的即刻细胞活性和固定化后储存7天的细胞活性。结果表明,包封率保持在40%左右,固定化酵母细胞即使保存7天仍可保持活性,这为静电纺丝固定化技术提供了良好的应用前景。
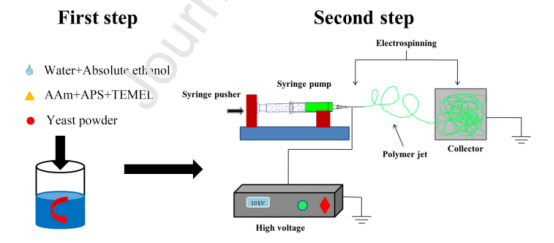
图1.纺丝液的制备和静电纺丝流程图。
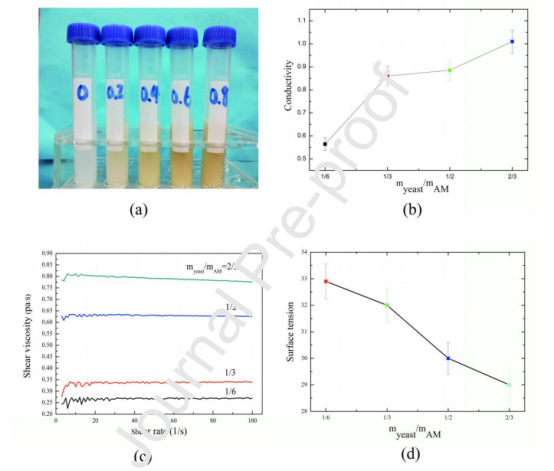
图2.不同PAAm/酵母含量的PAAm/酵母纺丝液的物理性能:(a)溶液外观,(b)溶液电导率,(c)溶液剪切粘度,(d)溶液表面张力。
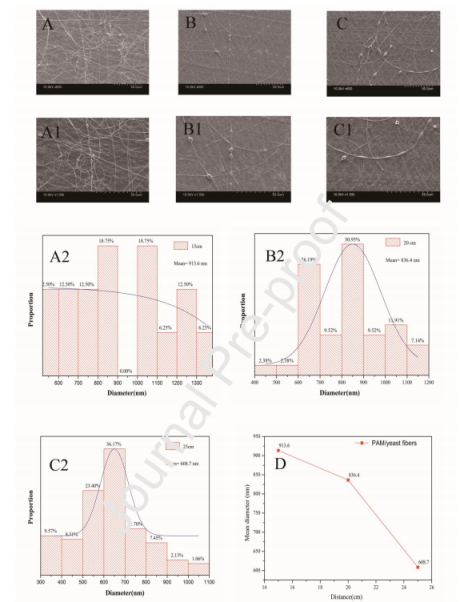
图3.PAAm/酵母复合纳米纤维在不同接收距离下的SEM照片:(A,A1)15cm(B,B1)20cm(C,C1)25cm。纺丝电压:15kV;前进速度:1.1mL/h;在不同接收距离下电纺PAAm/酵母纳米纤维的直径分布:(A2)15cm,(B2)20cm,(C2)25cm。(D)电纺PAAm/酵母纳米纤维的平均直径随接收距离而变化。
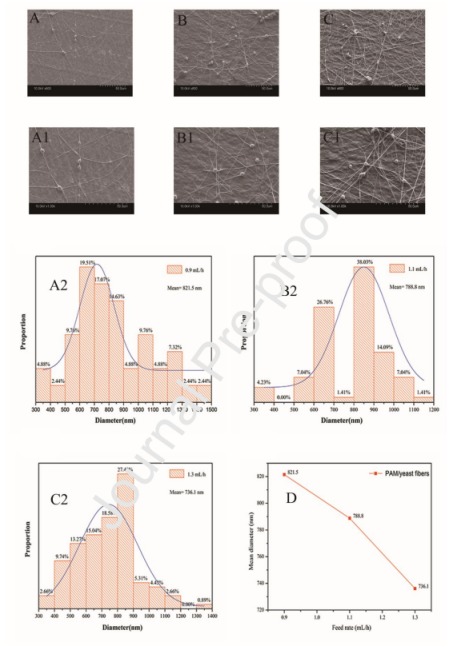
图4.PAM/酵母复合纳米纤维在不同进料速度下的SEM图像:(A,A1)0.9mL/h。(B,B1)1.1mL/h。(C,C1)1.3mL/h。纺丝电压:15kV;收集距离:20cm。在不同进料速率下电纺PAM/酵母纳米纤维的直径分布:(A2)0.9mL/h,(B2)1.1mL/h,(C2)1.3mL/h。(D)电纺PAM/酵母纳米纤维的平均直径随进料速率而变化。

图5.由珠状结构确定固定化结构:(A,A1)酵母菌在溶液中的形状,(B,B1)静电纺丝过程中的珠状结构,(C,C1)在电纺纳米纤维中固定的酵母结构。
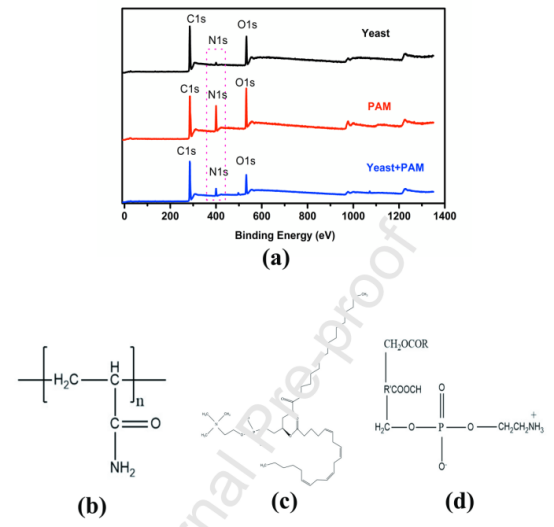
图6.(a)活性干酵母粉,纯PAAm纳米纤维膜,PAAm/酵母复合纳米纤维膜的XPS全谱;(b)PAAm结构;(c)磷脂酰胆碱结构;(d)磷脂酰乙醇胺结构。
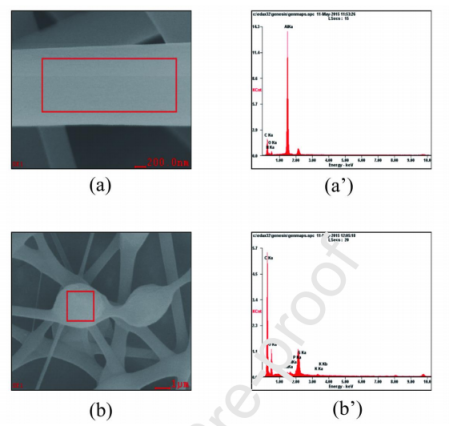
图7.SEM和EDX分析能谱,(a,a')PAAm纳米纤维,(b,b')固定化结构。

图8.CTC染色活性测试的CLSM图像:(a)游离酵母,(b)固定化酵母。

图9.亚甲基蓝染色后在光学显微镜下的观察。(a,a’)游离酵母。(b,b’)固定化酵母。(c,c’)7天后的固定化酵母。(a,b,c)放大20×0.4,(a’,b’,c’)放大40×0.55。
