DOI: 10.1016/j.msec.2021.112001
在本研究中,通过静电纺丝技术设计并制备了一种不对称双层膜,作为潜在的伤口愈合应用工具。用聚氨酯-聚己内酯(PU-PCL)共聚物制备了疏水层,并负载抗菌环丙沙星,用结冷胶(GG-C8)和聚乙烯醇(PVA)的辛基衍生物制备了离子响应型亲水层,并负载生长因子FGF-2。本工作研究了离子交联亲水层对负载活性物质的不对称膜性能的影响。尤其,亲水层经DPBS处理以及在0.1或1M CaCl2中的交联影响了生物活性分子的释放曲线,从而能够调节在NIH 3T3细胞系上的抗菌作用和趋化因子特性。
图1.SEM显微照片:a)GG-C8/PVA电纺丝层,b)含FGF-2的GG-C8/PVA电纺丝层。

图2.SEM显微照片:a)由DMF溶液制备的PU-PCL电纺丝层,b)由体积比为1:1的DMF:THF混合物制备的PU-PCL电纺丝层,c)通过喷雾干燥技术制备的干燥CPX MPs,d)负载CPX的PU-PCL电纺丝层。

图3.(a)折叠双层电纺膜的图像。(b)两层之间横截面的SEM图像,(c)完全干燥的双层电纺膜的图像。
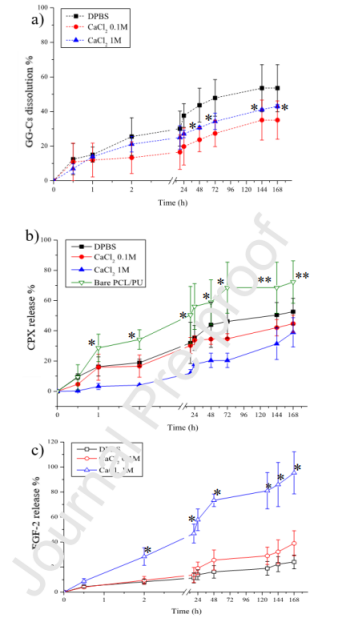
图4.Franz细胞实验。a)GG-C8溶出度百分比。从24到168h,*p<0.005。CaCl2交联样品之间无统计学显著性差异,b)CPX释放百分比。将裸PU-PCL与DPBS、CaCl2 0.1和CaCl2 1M处理的样品进行比较,从1到72h,*p<0.005,在144和168h,**p<0.01。c)在受体室中检测到的FGF-2释放百分比随时间的变化。数据表示为平均值±标准偏差。将DPBS处理的样品与CaCl2交联的样品进行比较,*p<0.005。
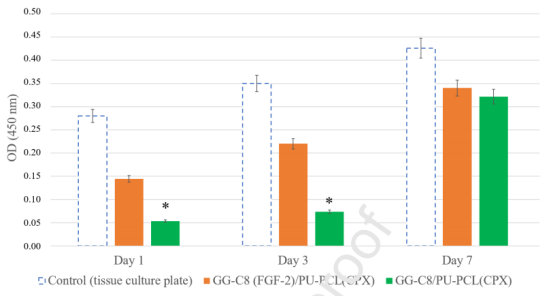
图5.通过MTS测定法分析负载FGF-2和不含FGF-2的双层膜上培养的NIH 3T3成纤维细胞随时间的变化。数据表示为在492nm处的吸光度平均值±SD,与直接在TCP 48孔上生长的对照成纤维细胞进行比较。*符号表示与负载FGF-2的膜相比,不含FGF-2的膜的吸光度具有统计学差异(p<0.005)。
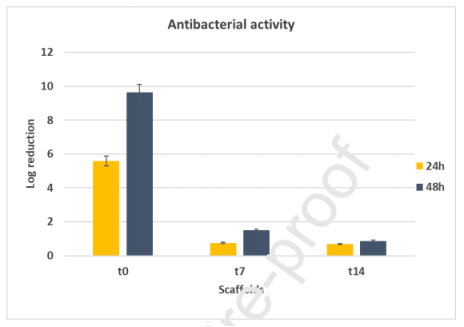
图6.负载抗生素CPX(2%w/w)(t0)的膜对金黄色葡萄球菌ATCC 25923的抗菌活性,膜在体外释放实验中的第7(t7)和14(t14)天后恢复。直方图显示在不同的孵育时间(24和48h)下金黄色葡萄球菌生长的对数减少。

图7.在NIH 3T3成纤维细胞上进行划痕试验,该成纤维细胞在经DPBS单独处理或用CaCl2(0.1或1M)交联的圆形双层膜(负载FGF-2和CPX)条件培养基中培养24h。用无血清DMEM培养的细胞作为对照。

图8.NIH 3T3成纤维细胞通过与仅使用DPBS处理的负载FGF-2和CPX的双层膜(图a)或用0.1M(图b)和1M(图c)CaCl2交联的双层膜接触的MatrigelTM层迁移的图像。所有调查样品每个区域的细胞迁移数(图d)。数据表示为平均值±标准偏差。
