DOI: 10.1021/acsnano.0c09913
将光敏剂工程化为刺激响应型超分子纳米药物可以增强光敏剂的时空递送和可控释放,在肿瘤光动力治疗中具有广阔的应用前景。纳米药物制备复杂,具有良好的肿瘤积聚能力,药物组分的不良反应阻碍了光动力疗法(PDT)在体内的应用。在制备肿瘤靶向给药的纳米药物时忽略了细胞外三磷酸腺苷(ATP)在肿瘤组织中过表达的事实。在此,研究者提出了由阳离子卟啉和ATP的共组装在水溶液中形成可作为PDT纳米药物的无金属螺旋纳米纤维。纳米药物材料易于获得、相容性好、制备简单,使其在PDT治疗肿瘤方面具有广阔的应用前景。与单独使用阳离子卟啉相比,卟啉-ATP纳米纤维通过全身血液循环显示出增强的肿瘤部位光敏剂递送。过表达的细胞外ATP稳定了肿瘤组织内的卟啉-ATP纳米药物,从而增强了癌细胞对纳米药物的吸收。通过细胞内磷酸酶对ATP进行生物降解后,酶触发的光敏剂从纳米药物中释放出来,产生了良好的肿瘤治疗效果。这项研究利用肿瘤微环境帮助纳米药物在肿瘤部位积聚,对智能纳米药物的制备具有一定的启发意义。
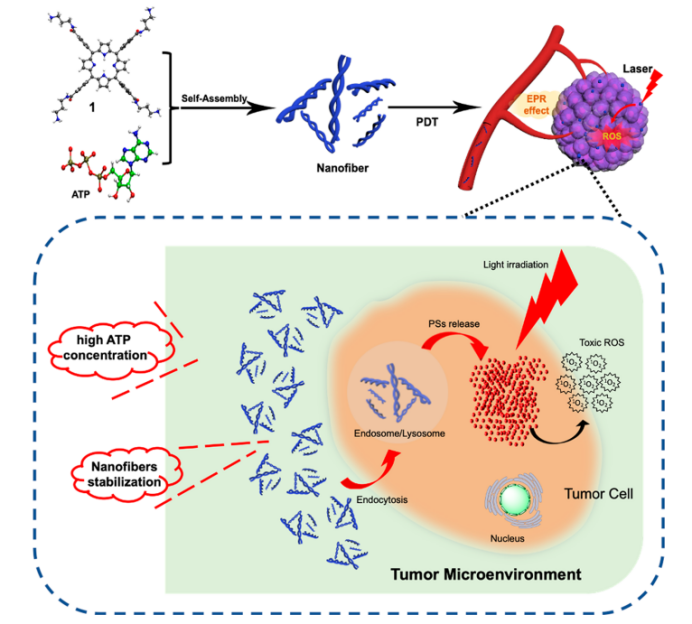
图1.水溶性卟啉的三磷酸腺苷(ATP)模板化自组装用于成像引导的精确光动力疗法(PDT)的示意图。
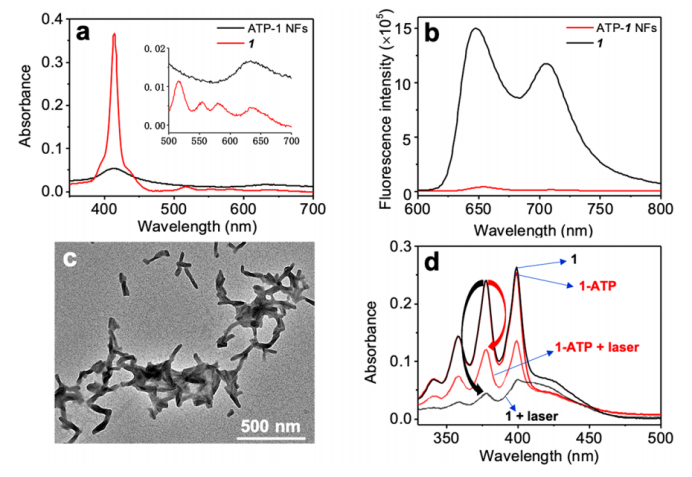
图2.水中卟啉1和1-ATP纳米纤维的紫外可见吸收光谱(a)和发射光谱(b)。Λexc=592nm。(c)1-ATP纳米纤维的TEM图像。(d)当存在卟啉1或1-ATP纳米纤维时,分别在有无激光照射的条件下测定ROS探针(ABDA)在水中的吸光度。黑色箭头(对于卟啉1)和红色箭头(对于1-ATP)表示激光照射后ABDA的吸光度变化。在a-c中:[1]=[1-ATP]=20μM。在d中:[1]=[1-ATP]=5μM。[ABDA]=1.67mM,激光功率:0.3 W cm-2,在635nm下持续10分钟。a中的插图显示了Q波段的扩展吸光度。
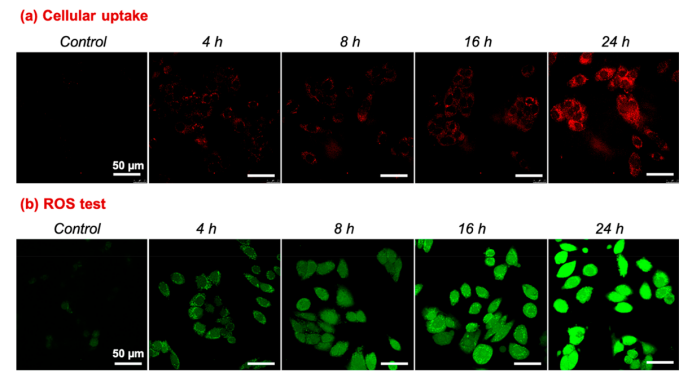
图3.(a)用1-ATP纳米纤维孵育的MCF7细胞的CLSM图像显示,与未加入1-ATP纳米纤维的对照实验相比,随着孵育时间的增加,红色荧光强度逐渐增强。(b)细胞的荧光图像显示辐照和1-ATP纳米纤维的结合产生了ROS。如图所示,将细胞与1-ATP纳米纤维孵育不同的时间,然后与10μM DCFH-DA孵育0.5h,随后用635nm激光(0.3 W cm-2)照射2分钟。a和b部分的对照实验未添加1-ATP纳米纤维,图像是在孵育24h后拍摄的。
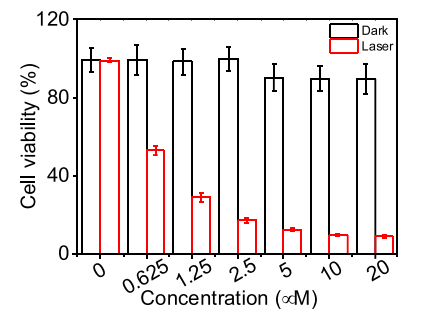
图4.在有或没有光照射的情况下,用1-ATP纳米纤维孵育的MCF7细胞的活性。1-ATP纳米纤维的浓度范围为0至20μM。孵育24h后,以635nm激光在0.3 W cm-2下照射1分钟。误差棒代表标准偏差(n=6)。
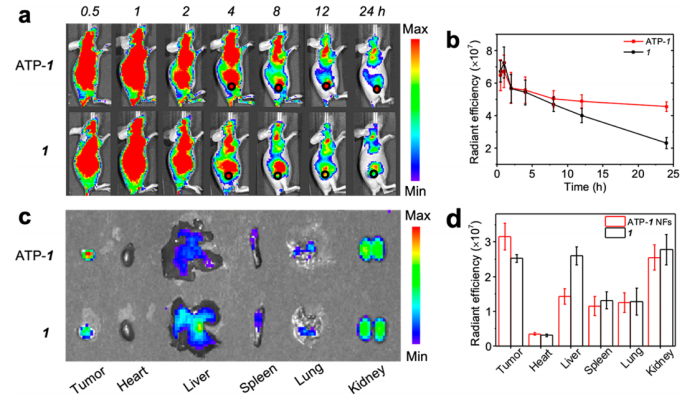
图5.(a)荧光图像显示根据肿瘤部位的强荧光发射,1-ATP纳米纤维比未包封的卟啉能更好地在肿瘤部位递送卟啉。黑色圆圈表示肿瘤的大小和位置。(b)从分别注射了1-ATP和卟啉1的小鼠的肿瘤部位获取的平均荧光强度。(c)注射后24h采集的离体器官荧光图像。(d)从分别注射了1-ATP和卟啉1的小鼠的离体器官获取的荧光强度。误差棒代表标准偏差(n=3)。
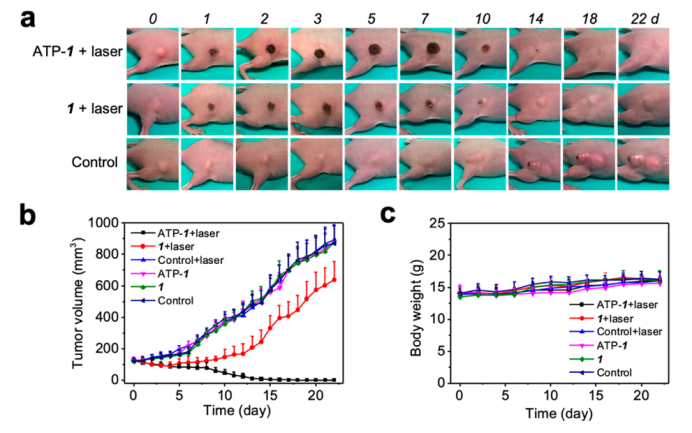
图6.使用1-ATP纳米纤维的体内PDT。(a)荷瘤小鼠PDT各时间点的代表性照片。给小鼠注射1-ATP纳米纤维、未包封的卟啉1或5%葡萄糖的水溶液(对照组)。注射后4h,所有肿瘤部位均用635nm激光照射10分钟(0.3 W cm-2)。(b)观察期间的肿瘤生长情况。(c)观察期间小鼠的体重。误差棒代表标准偏差(n=5)。
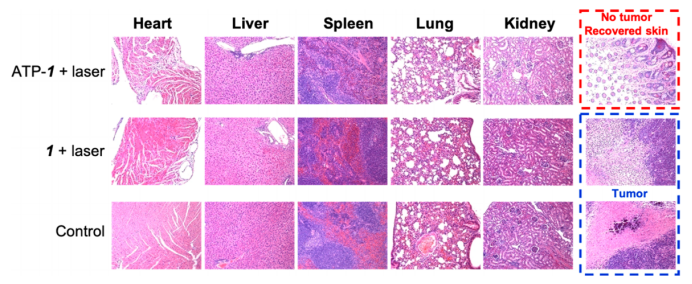
图7.对照组以及PDT组小鼠心脏、脾、肾、肝、肺和肿瘤组织的苏木精和伊红(H&E)染色组织切片。
