糖尿病慢性皮肤创面因细菌感染和血管再生不足等问题导致愈合障碍,已成为全球公共卫生领域的重大挑战。仿生超细复合纤维在促进创面愈合方面具有巨大的潜力,铜(Cu)作为人体必需的微量元素,兼具广谱抗菌和促进血管生成作用,而碱性成纤维细胞生长因子模拟肽(FGFp)能有效促进细胞的增殖和迁移。然而,受限于超细纤维中两种活性因子过快释放行为,开发高效负载活性因子的纤维膜皮肤组织工程支架仍面临巨大挑战。

近日,青岛大学纺织服装学院周芳助理教授、徐英俊教授等在期刊《Materials Today Bio》上,发表了最新研究成果“FGF mimetic peptide-modified electrospun nanocomposite fibrous membranes for accelerating infectious diabetic wound healing by synergistic antibacterial and pro-angiogenesis effects”。研究者通过水热法、静电纺丝和表面化学改性等工艺,将成纤维细胞生长因子模拟肽(FGFp)和负载Cu/儿茶酚衍生树脂纳米粒子(CuCFR)的聚(L-丙交酯-co-ε-己内酯)(PLCL)电纺纤维膜相结合,制备出一种高效复合纤维膜材料(CuCFR-FGFp),该纤维膜通过表面化学接枝FGFp和内部物理封装CuCFR纳米粒子,可持续释放两种活性因子FGFp和Cu²⁺达14天,表现出良好的抗细菌感染和促进管腔形成的能力,并在细菌感染糖尿病小鼠创面模型中该纤维膜中Cu2+和FGFp协同作用显著提高了血管标志物表达和促进伤口愈合能力。该研究为开发长期高效载药复合纤维皮肤组织工程支架提供了新思路。
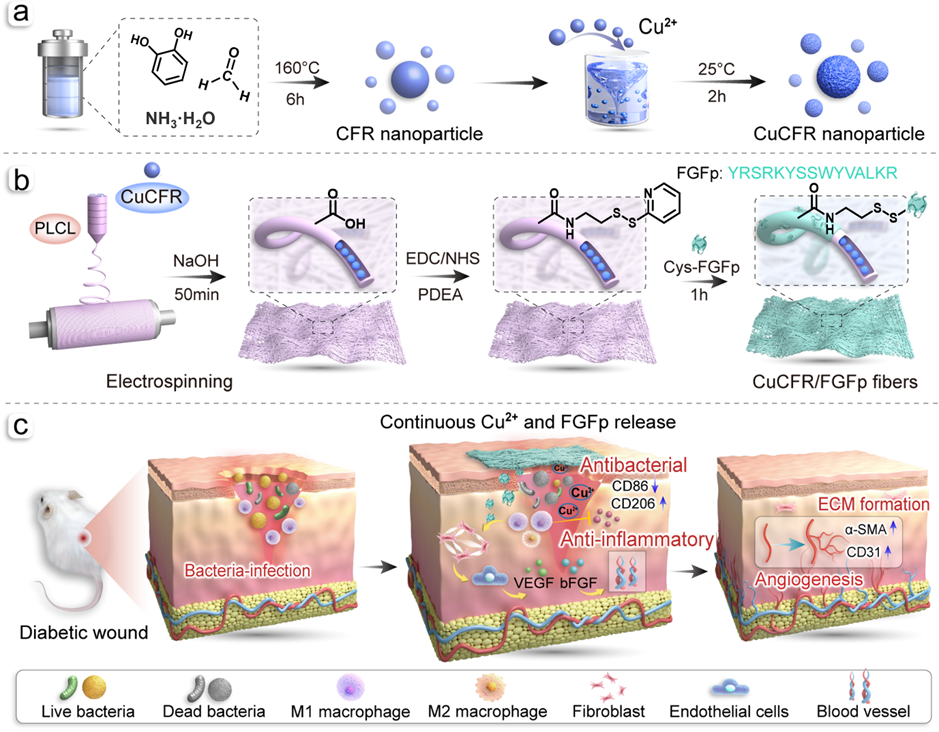
图1:CuCFR 纳米粒子及CuCFR-FGFp复合纤维膜的制备示意图
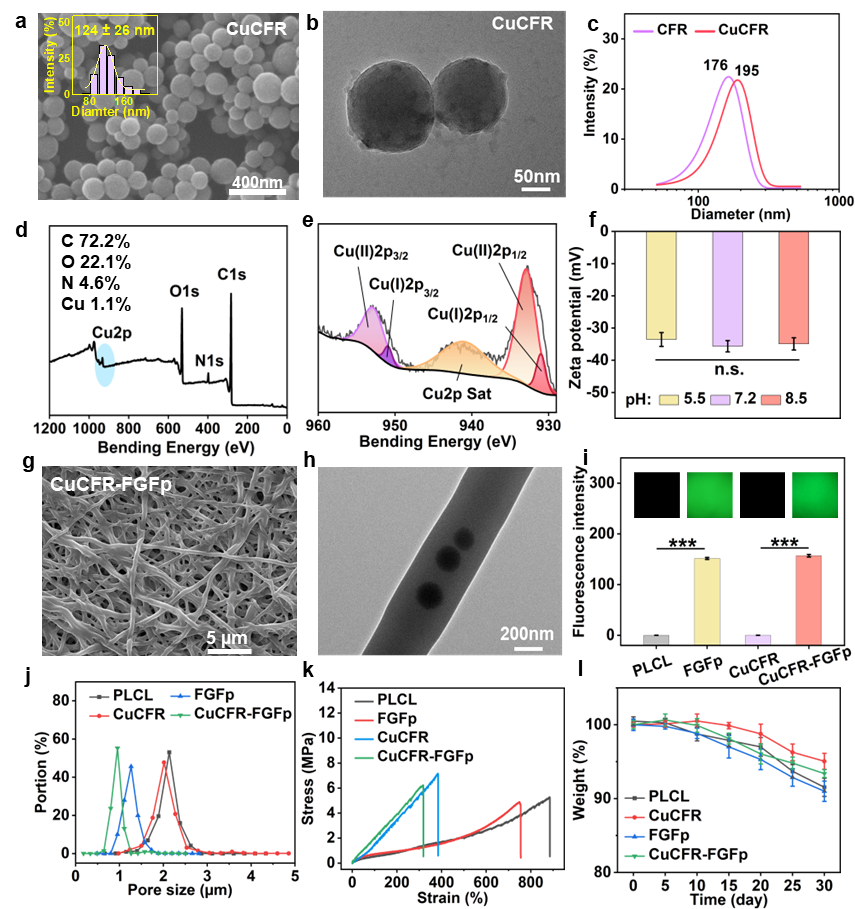
图2:CuCFR 纳米粒子及CuCFR-FGFp功能化复合纤维膜的表征
依靠两步法策略制备CuCFR 纳米粒子并包载于电纺超细纤维内部;随后利用二硫键介导的点击化学反应将FGFp化学偶联至纤维膜表面,使纤维膜保持良好的多孔超细纤维形态和较好的拉伸性能(拉伸强度6.2MPa和伸长率317%),为两种活性因子的持续释放性和生物活性的体现提供了必要支撑。
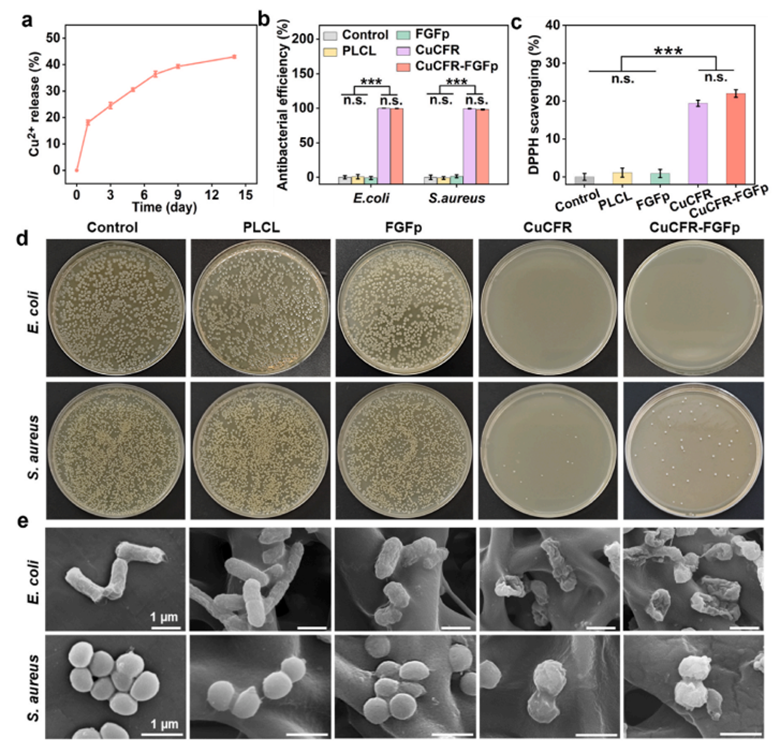
图3:制备的CuCFR-FGFp复合膜的抗菌性能
得益于CuCFR 纳米粒子的独特结构,CuCFR-FGFp复合膜可持续释放Cu²⁺达14天,由于Cu2+增加了细胞膜的通透性,从而导致金黄色葡萄球菌和大肠杆菌的表面变得粗糙、扭曲、塌陷,细菌内容物流出,进而有效抑制金黄色葡萄球菌和大肠杆菌的生长繁殖(抑菌率>98%),而FGFp的引入未对抗菌活性产生显著性影响。
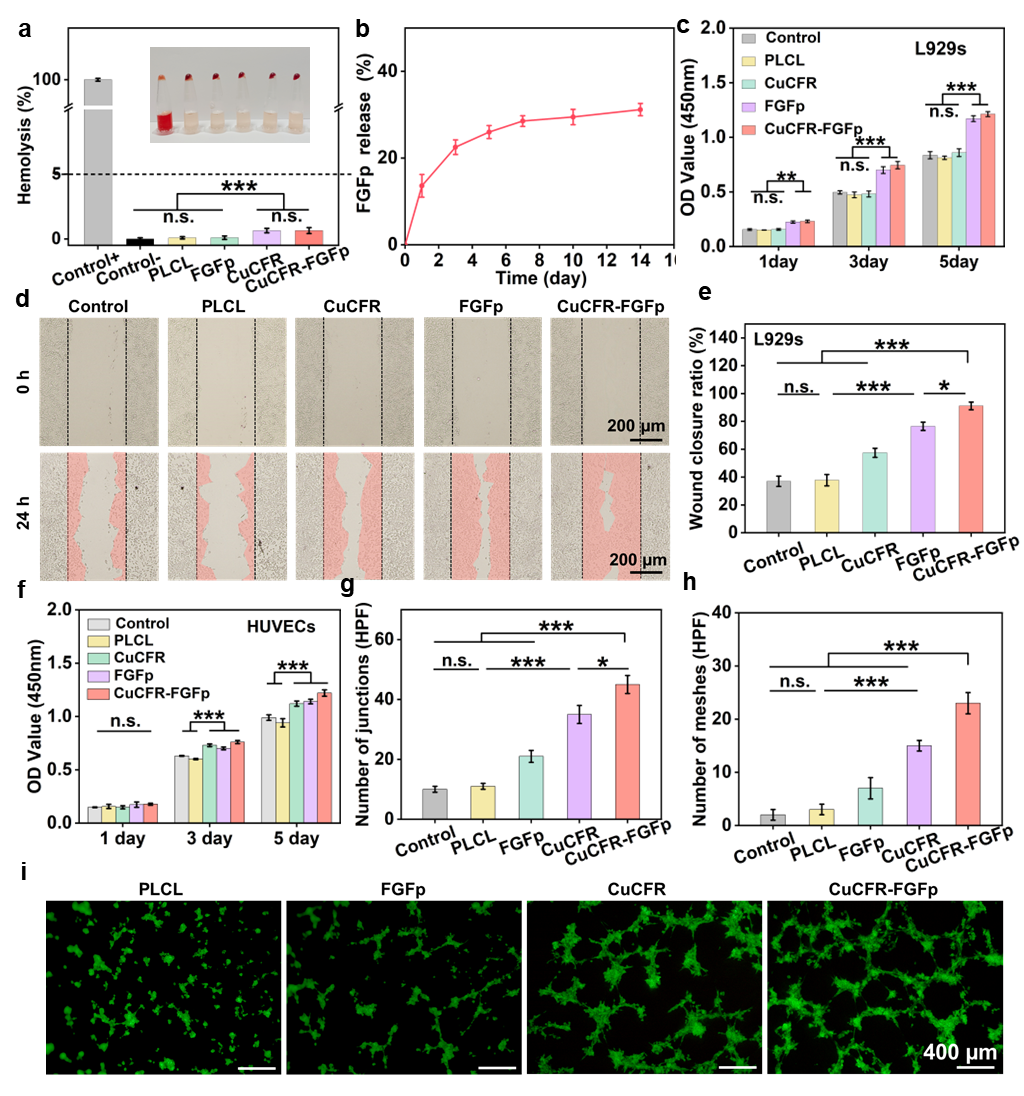
图4:制备的CuCFR-FGFp复合膜对成纤维细胞增殖和内皮细胞成管性能
体外生物学安全性评价结果表明,CuCFR/FGFp复合膜的溶血率低于1%,且与皮肤成纤维细胞和血管内皮细胞共培养24、72 h后均展现出良好的细胞活性。得益于Cu2+和FGFp两种活性因子的协同作用,CuCFR/FGFp纤维膜对成纤维细胞和内皮细胞的增殖、迁移以及内皮细胞的成管能力具有更显著的促进作用。

图 5. 体内CuCFR-FGFp复合膜对细菌感染的糖尿病伤口愈合能力评估
体内研究结果表明,CuCFR/FGFp纤维膜处理的糖尿病小鼠感染创面,新生表皮增厚至约43.7 µm、胶原沉积显著提升3.4倍、毛囊等皮肤附属物显著增加,有效促进了糖尿病小鼠感染创面愈合。此外,Cu2+的释放起到体内抗细菌感染和促进巨噬细胞极化的作用(CD86表达水平降低,CD206表达水平提升);在Cu2+和FGFp协同作用下,复合膜显著促进血管标志物(CD31和α-SMA)表达水平提高约3倍,有效加速了糖尿病小鼠感染创面愈合,在糖尿病慢性皮肤创面治疗领域展现出巨大的应用潜力。
论文链接:
https://www.sciencedirect.com/science/article/pii/S2590006425004375?via%3Dihub
